发布日期:2025-12-17浏览次数:279来源:蓝景科信
2025年11月11日,天津大学王方忠教授团队在Chemical Engineering Journal(IF: 13.2)在线发表了题为Accelerated fatty acid biosynthesis by an RCC1-domain protein enables record-high productivity in Schizochytrium的研究论文,该研究借助DAP-seq技术阐明了RCC1结构域蛋白Srcc1在裂殖壶菌中调控脂肪酸生物合成的机制及其在高密度发酵中的应用,将微生物油脂生产推向了新的高度。蓝景科信为该研究提供了DAP-seq技术支持。

化石燃料枯竭及环境问题推动了可再生能源与高价值脂肪酸(如生物柴油原料、ω-3多不饱和脂肪酸)的可持续生产需求。微生物细胞工厂因避免与粮食作物争地、环境友好等优势成为脂肪酸合成的理想选择,但普遍存在产量和生产力低的问题,限制了其商业化竞争力。裂殖壶菌(Schizochytrium sp.)作为海洋异养微藻,具有生长快速、生物量积累能力强、脂质含量高的特点,是极具潜力的生产宿主,但有限的遗传工具制约了其代谢网络重编程效率,需挖掘新型调控机制提升脂肪酸合成效率。Regulator of Chromosome Condensation 1(RCC1)蛋白作为核蛋白,已被证实可提升纤维素酶和乙醇的生产效率,但在脂肪酸生物合成中的作用尚未被探索。
主要研究结果
核心发现一:构建高密度发酵平台,精准鉴定脂肪酸合成关联蛋白 Srcc1
1、新型调控因子Srcc1的鉴定
本研究以裂殖壶菌ZW0菌株为研究对象,建立高密度发酵工艺,并同时结合时间序列转录组分析,追踪脂肪酸合成关键时期的基因表达动态。结果显示有一个基因呈现出与脂肪酸积累显著的共表达模式:在脂质快速合成阶段,该基因表达量持续上调。通过BLASTp分析发现,该基因编码一种含保守RCC1结构域的未表征蛋白(Srcc1)。序列比对结果证实,Srcc1在破囊壶菌科内具有保守性,同时在解脂耶氏酵母等其他产油酵母中也存在亲缘关系较远的同源蛋白。鉴于该基因的表达与脂质积累表型的紧密共表达特性,以及其在不同产油微生物中的系统发育保守性,提示其可能参与脂肪酸合成调控。
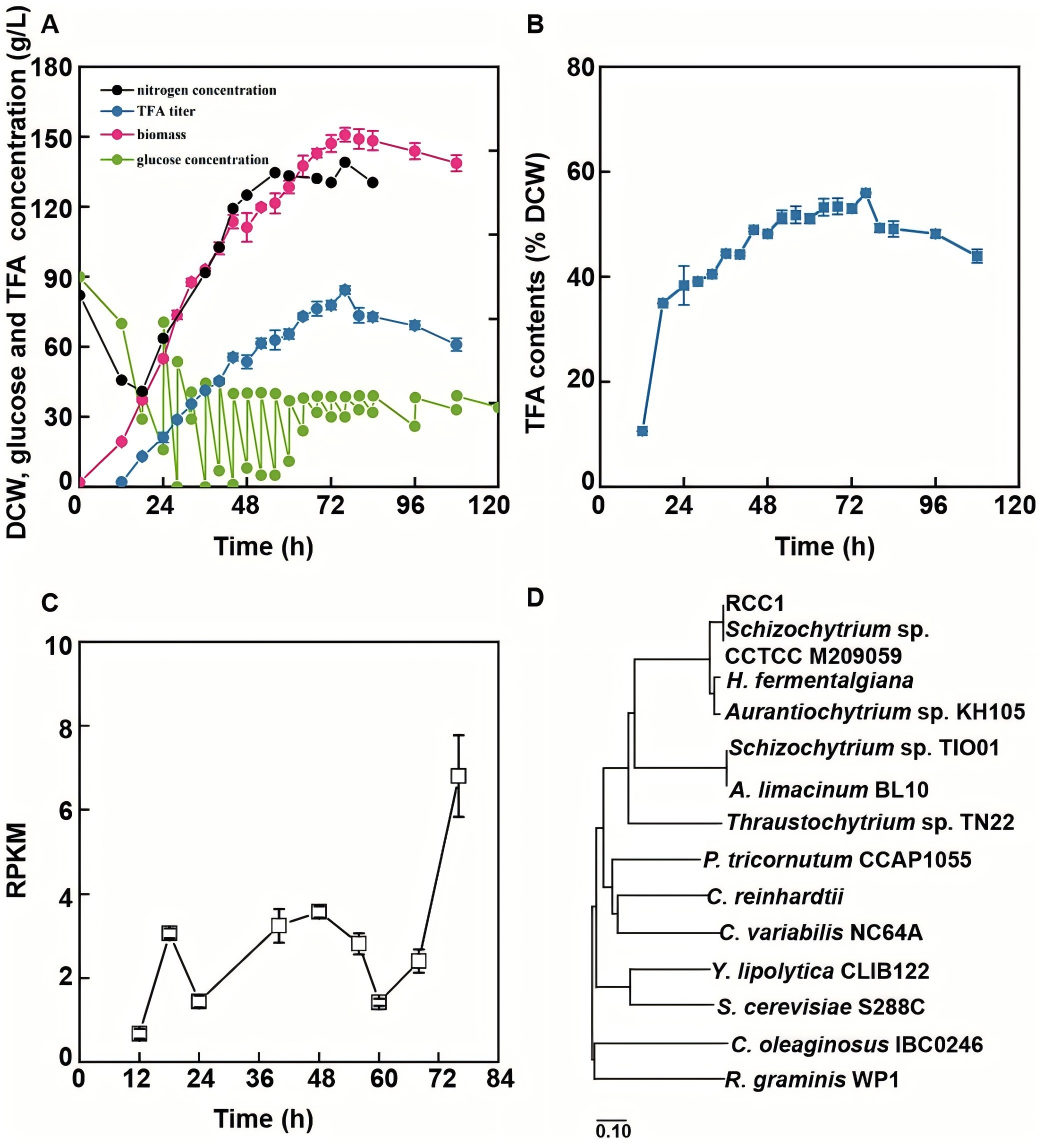
图1 在5升生物反应器中对ZW0菌株进行发酵及保守的RCC1蛋白鉴定
2、Srcc1功能验证
过表达Srcc1后,裂殖壶菌的脂肪酸合成速率提升1.35-1.41倍,总脂肪酸含量增加1.30-1.33倍,细胞内脂质滴面积扩大3.36-3.93倍,细胞体积增大1.79-2.59倍。进一步在不同碳氮比(3:1和5:1)条件下验证,证实Srcc1对脂肪酸合成的促进作用具有稳定性,且不依赖特定C/N环境。随后,作者检测了C40(碳氮比=2:1)和C100(碳氮比=5:1)培养条件下三羧酸循环(TCA 循环)关键酶的活性及相关代谢物水平,发现该增效不影响三羧酸循环功能,仅增强柠檬酸向乙酰辅酶A的碳通量。
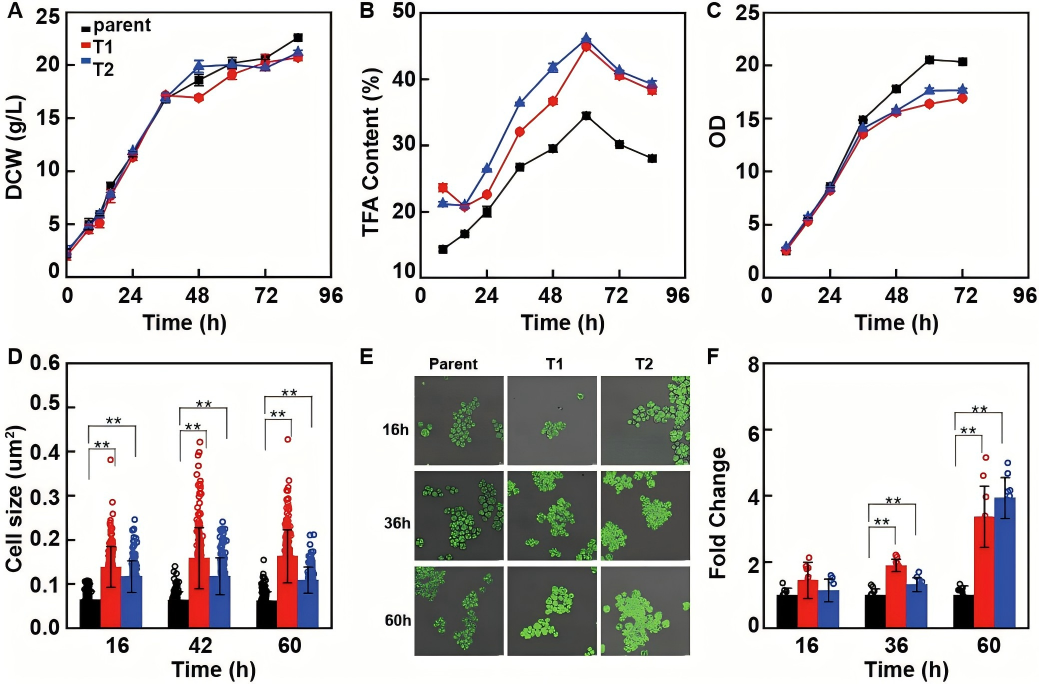
图2 亲本菌株与RCC1转化子的发酵性能比较
核心发现二:三靶基因协同作用介导Srcc1的脂肪酸调控效应
1、解析Srcc1核定位特性
为探究Srcc1是否在转录水平影响脂肪酸合成,构建Srcc1-GFP融合表达载体并转化裂殖壶菌,结合DAPI核染色与共聚焦显微镜证实,该蛋白特异性定位于细胞核,这支持其作为转录调控因子的潜在功能。
2、锁定三大核心靶基因
为鉴定Srcc1的直接转录靶基因,作者开展了DNA亲和纯化测序(DAP-seq),并筛选出在两次重复实验中启动子区域结合峰均显著富集的基因。然后进一步挑选出脂肪酸降解、脂肪酸生物合成、NADPH生成及氧化还原酶活性相关通路的靶基因。通过Srcc1过表达菌株中候选基因的转录本水平,scaffold1256.g2、scaffold228.g6、scaffold287.g3、scaffold4.g24、scaffold51.g17及scaffold1693.g1被鉴定为Srcc1的潜在直接靶点。
进一步EMSA结果证实,Srcc1能与所有候选基因的启动子区域发生特异性结合。ChIP-qPCR实验结果可见,在scaffold4.g24(编码丙二酰辅酶 A:ACP 转酰酶)、scaffold287.g3(编码酰基辅酶A合成酶)和scaffold1693.g1(编码NAD激酶)的启动子区域检测到Srcc1的显著富集,而在scaffold51.g17、scaffold228.g6和scaffold1256.g2的启动子区域未检测到显著富集。这些结果表明,Srcc1可直接激活丙二酰辅酶A:ACP转酰酶、酰基辅酶A合成酶以及NAD激酶的转录,从而促进裂殖壶菌ZW0菌株中的脂肪酸生物合成。
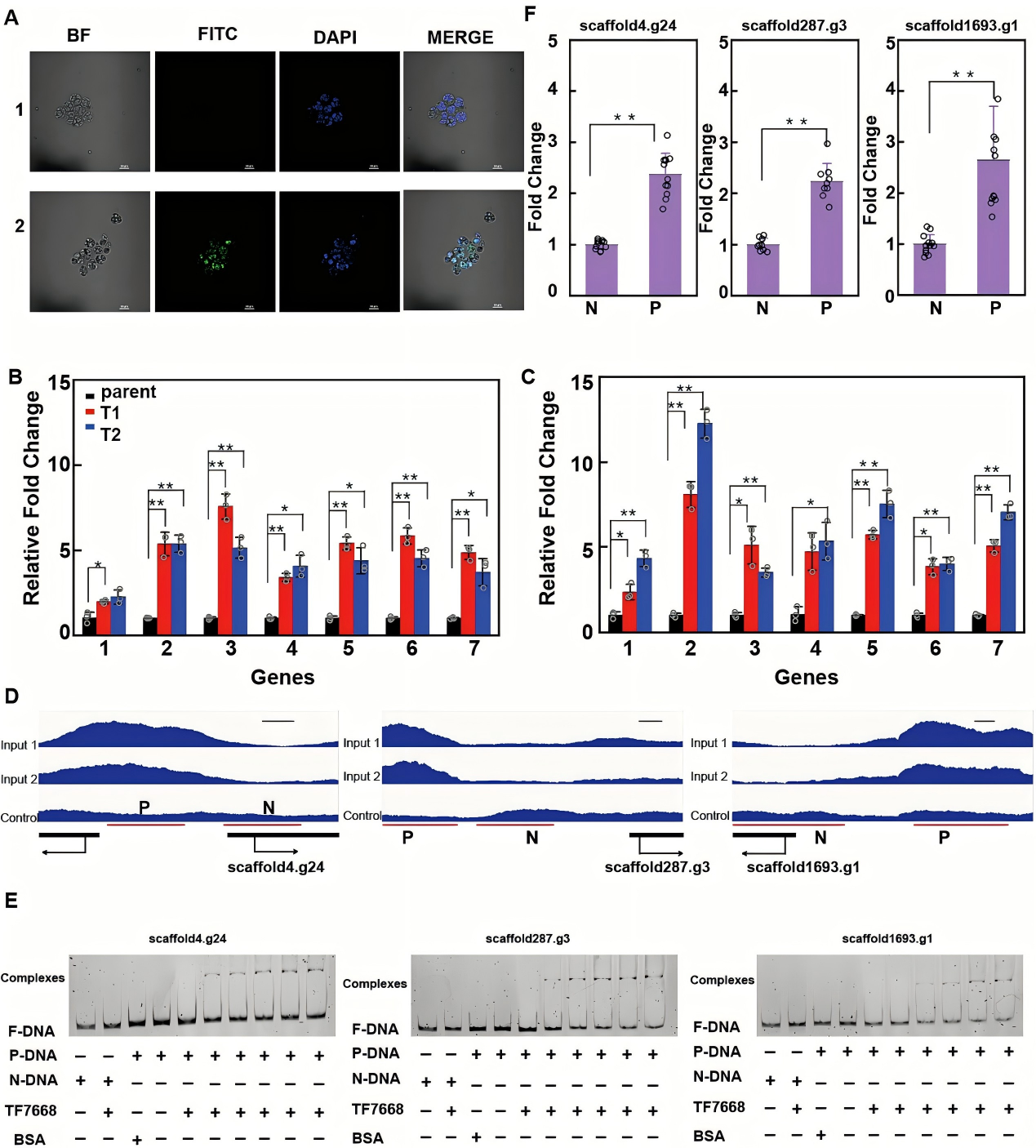
图3 RCC1对脂肪酸合成的直接调控机制
3、解析Srcc1介导的脂肪酸生物合成调控网络
为评估每个Srcc1靶向基因对脂肪酸积累的独立作用,作者分别构建三个靶基因的单独过表达载体及三基因共表达载体,转化裂殖壶菌后进行发酵表型分析(DCW、TFA 含量、积累速率测定),发现单独过表达单个靶基因仅能部分重现Srcc1过表达的脂肪酸增强表型,而三基因共表达菌株可恢复Srcc1介导的脂肪酸合成速率和含量提升效应的90%以上,证实这三个基因是Srcc1调控脂肪酸生物合成的核心功能靶标,其协同作用构成Srcc1调控网络的关键通路。
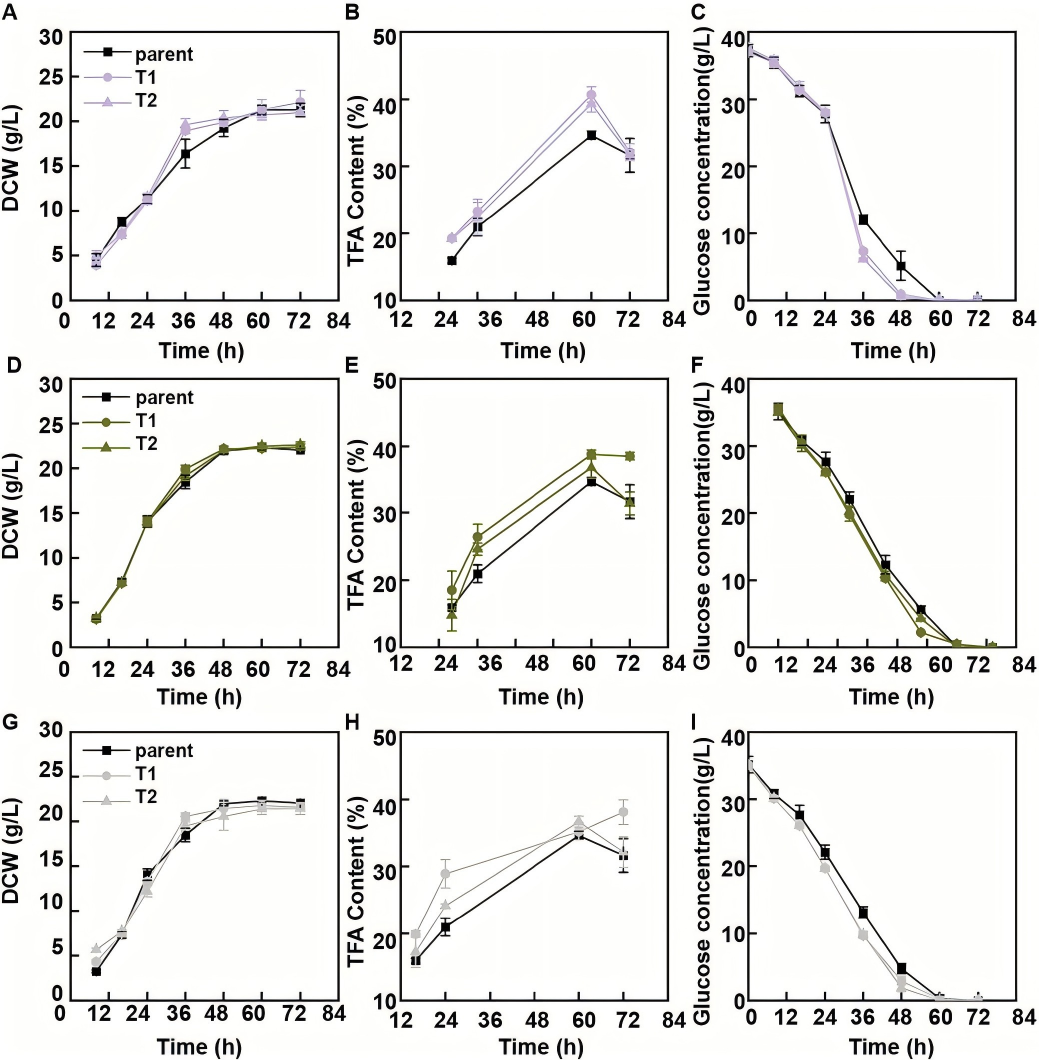
图4 亲本菌株与单基因过表达菌株的发酵特性
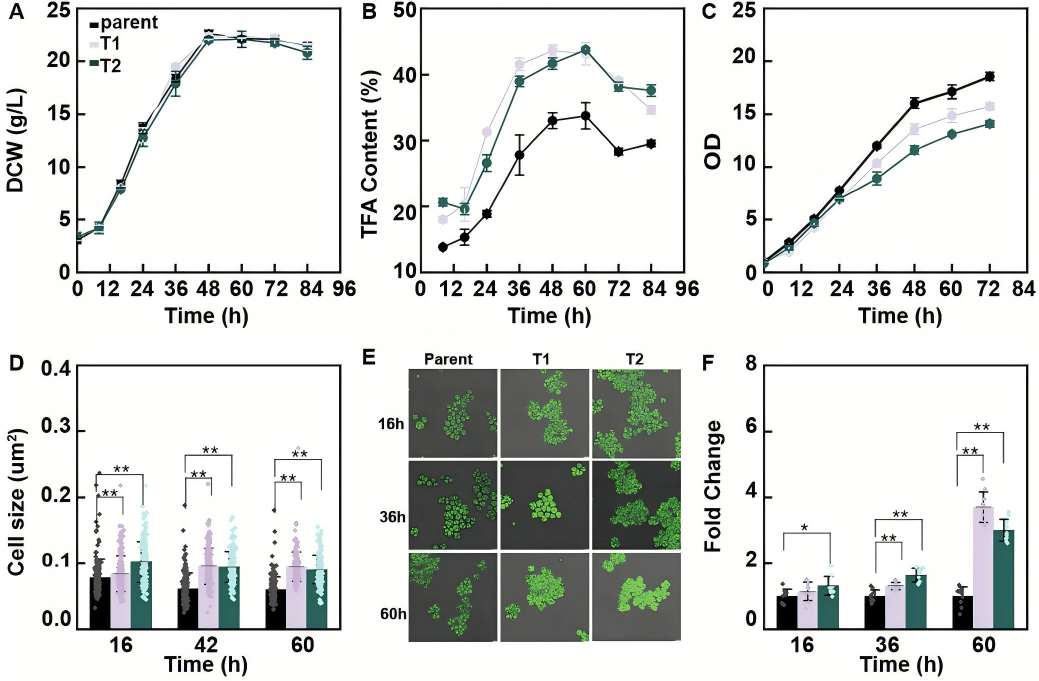
图5 亲本菌株与三基因过表达菌株的表型比较
核心发现三:Srcc1工程菌株发酵性能突破已知微生物平台
在5-L生物反应器中,Srcc1过表达菌株的总脂肪酸含量、效价、得率和生产强度较原始菌株分别提升1.20倍、1.27倍、1.27倍和1.42倍,发酵周期缩短8小时。最终脂肪酸甲酯(FAME)效价达107.28±4.94 g/L,生产强度为1.58±0.07 g/L/h,超越目前已报道的微生物产脂系统(包括裂殖壶菌、解脂耶氏酵母等底盘)。
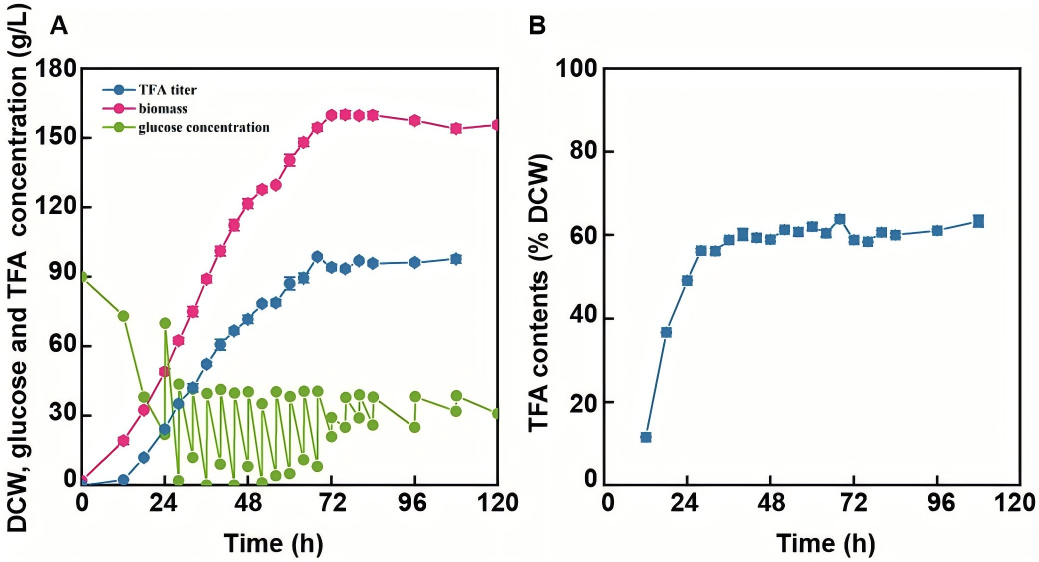
图6 裂殖壶菌RCC1-1菌株在5升生物反应器中的发酵曲线
小结
本研究首次揭示了RCC1结构域蛋白Srcc1作为转录激活因子,通过直接调控三个关键酶基因协同促进裂殖壶菌脂肪酸合成的机制。构建的高产工程菌株具有发酵周期短、产率高、成本低的优势,为生物柴油、营养脂质(如DHA)等产品的工业化生产提供了优质底盘和技术支撑。为产油微生物的多靶点转录工程提供了新范式,对推动生物基化学品的可持续生产具有重要意义。
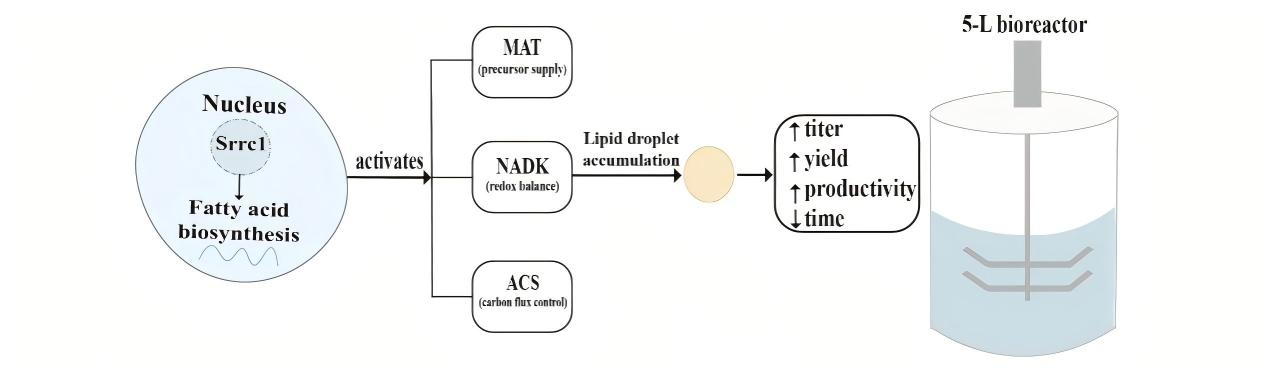
图7 Srcc1调控脂肪酸合成的机制解析模式图
原文链接:https://doi.org/10.1016/j.cej.2025.170743